To totally unlock this section you need to Log-in
Login
L'affinità elettronica e' definita come la variazione di energia, cambiata di segno, che si ha quando un atomo neutro allo stato gassoso acquista un elettrone diventando ione negativo:
Con questa definizione, un grande valore di affinita' elettronica significa un valore molto negativo di , cioe' l'energia dello ione negativo e' molto piu' bassa di quella del sistema costituito dall'atomo neutro e dall'elettrone separati: quindi, un alto valore di affinita' elettronica significa che il processo di formazione dello ione negativo (acquisto di un elettrone) e' energeticamente favorito. Viceversa, un basso valore di affinita' elettronica significa che l'elemento ha scarsa tendenza ad acquistare un elettrone addizionale.
In linea di massima, l'affinita' elettronica aumenta (cioe' l'acquisto di un elettrone e' sempre piu' energeticamente favorito) spostandosi da sinistra verso destra lungo un periodo, a causa dell'aumento della carica nucleare efficace, che lega piu' fortemente l'elettrone addizionale. L'andamento lungo un gruppo e' meno definito, ma ci si aspetterebbe una diminuzione dell'affinita' elettronica (cioe' una tendenza ad acquistare un elettrone in piu' via via minore) col numero atomico, visto che l'elettrone addizionale dovrebbe essere sistemato in un orbitale con numero quantico principale via via crescente.
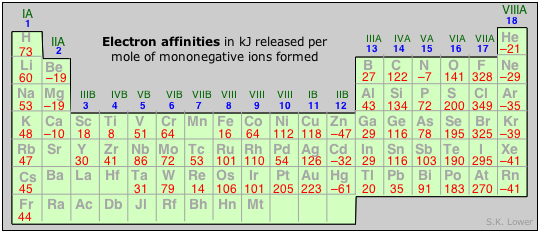
Gli elementi con i valori maggiori di affinita' elettronica (cioe' quelli che hanno la maggiore tendenza ad aquistare un elettrone per dare ioni negativi) sono quelli della parte destra della tavola periodica e in particolare gli alogeni.
Definizione
L'affinità elettronica viene definita come l'energia, espressa in Kcal/mol (o KJ/mol), liberata da una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni monovalenti (ovvero si trasforma in una mole atomica ionizzata negativamente).
Come è possibile notare dalla tabella precedente, gli elementi del settimo gruppo sono quelli che hanno i valori di affinità elettronica più alta. Ciò è dovuto alla loro struttura elettronica esterna s2p5: con l'acquisto di un elettrone raggiungono la configurazione ad ottetto completo (s2p6) molto più stabile della precedente.
Comportamento dell'affinità elettronica:
L'affinità elettronica, in valore assoluto e salvo rare eccezioni, aumenta andando a destra nel periodo (poiché diminuisce lievemente il raggio (per via della forza attrattiva del nucleo) e aumenta il numero di elettroni sull'ultimo livello energetico, quindi l'atomo può raggiungere più facilmente la massima stabilità e diminuisce scendendo nel gruppo (sia per la distanza dal nucleo, sia per l'incremento del numero atomico, quindi anche di elettroni che esercitano una forza repulsiva che tende a destabilizzare l'atomo). Ad esempio: Fluoro (in alto a destra della tavola periodica) ha un'alta affinità elettronica perché gli manca un solo elettrone per ottenere il "guscio chiuso", quindi ottenuto un elettrone e perciò raggiunto il guscio, liberando energia si stabilizza.
Inoltre un fattore che influenza l'affinità elettronica è l'elettronegatività, in quanto atomi più elettronegativi avranno una tendenza maggiore ad acquisire elettroni. Questo spiega come mai il F ha una affinità elettronica molto elevata. Ciò che bisogna anche notare è la differenza di affinità elettronica tra Cl e F, in quanto, sebbene il F sia più elettronegativo del Cl, quest'ultimo presenta un valore di affinità elettronica maggiore. Questo è spiegato dal raggio dell'atomo stesso, in quanto il Cl è più grande del F e che quindi gli elettroni che vogliamo aggiungere negli orbitali esterni risentono in maniera minore della forza repulsiva esercitata dagli elettroni di valenza.
Affinità elettronica e convenzione sui segni
La definizione di affinità elettronica è contraria alla convenzione che vuole segno - (meno) all'energia liberata durante una reazione chimica.
Per tale motivo talvolta si preferisce definire l'affinità elettronica come l'energia che bisogna fornire (e quindi con segno +) ad uno ione negativo (anione) per strappargli un elettrone:
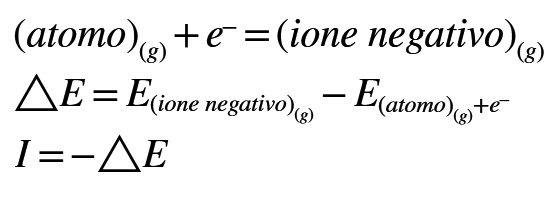
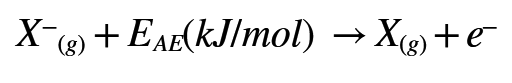


Affinità elettronica – in che rapporto o misura interagiscono differenti elementi chimici? Vi è una periodicità in questo comportamento? – http://heelpbook.altervista.org/2014/affinita-elettronica/ – #chimica on #heelpbook #science @heelpbook – Heelpbook.net